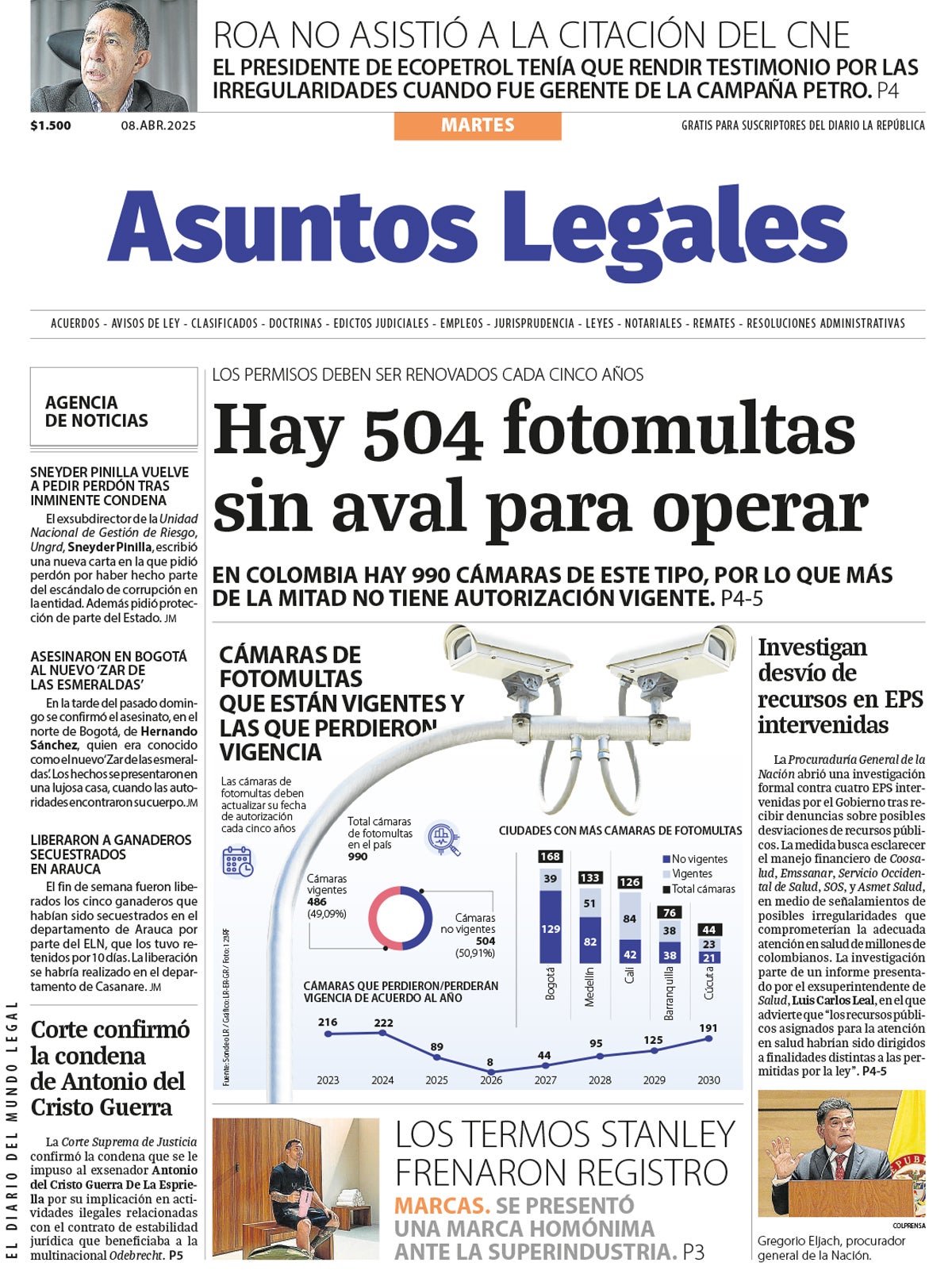
Invima ha emitido una serie de decretos y resoluciones que podrían llegar a permitir mejorar en los tiempos de respuesta para todos los trámites de medicamentos.
La norma principal es el Decreto 334 de 2022 por el cual se establecen disposiciones para la renovación, modificación y suspensión de registros sanitarios de medicamentos de síntesis química, gases medicinales, biológicos y homeopáticos; de información y publicidad de medicamentos y productos fitoterapéuticos; de adopción de medidas para garantizar el abastecimiento de medicamentos de síntesis química, gases medicinales y biológicos; y se dictan otras relacionadas con estos productos
Sin embargo, su entrada en vigor ha sido aplazada parcialmente hasta la emision de guías para su debida implementación. Estas guías en el año 2022 estuvieron a cargo de Invima, sin embargo, cuando se emitieron no captaron la iniciativa de la norma y se volvía a la solicitud de informacion y tramites innecesarios.
Este año el Ministerio de Protección Social, asumió el desarrollo de las guías junto con la industria. Por lo cual se comenzaron a emitir decretos por los cuales reactivan parte de los tramites incluidos en la norma base.
El Decreto 1474 inicio este proceso mediante la modificación, entre otros y el de mayor impacto, la vigencia que se otorga a un registro sanitario de medicamentos indicando que será indefinida, siempre y cuando mantenga las condiciones previamente aprobadas.
“El otorgamiento de la vigencia indefinida no impide que el Invima o la autoridad correspondiente, en ejercicio de las funciones de inspección, vigilancia y control, adopte las medidas necesarias al encontrar un incumplimiento de las normas técnicas que regulan la materia o identificar que existe un riesgo sanitario asociado a la farmacovigilancia durante el uso del medicamento”
Adicionalmente establece claramente las modificaciones sobre aspectos administrativo-legales, aspectos de calidad relacionados con cambios de riesgo menor, moderado y mayor, y medidas para prevenir y mitigar el desabastecimiento de medicamentos.
Con el fin de lograr las eficiencias perseguidas con su aplicación de las normas, las mesas de trabajo conjuntas entre los gremios de industria farmacéutica, Invima y Ministerio de Salud y Protección Socia determinaron contar con una transitoriedad de dos (2) meses que permitan el proceso de socialización y apropiación de las guías de forma previa, es decir que en noviembre comenzara a regir este decreto.
¿Quiere publicar su edicto en línea?
Contáctenos vía WhatsApp